
外泌体(exosomes)是由细胞内多泡体与细胞膜融合后,释放到细胞外基质中的一种直径约 30-120nm 的膜性囊泡。几乎所有种类的细胞都能分泌外泌体,并存在于人体各种体液之中,包括血液、尿液、唾液、乳汁、脑脊髓液等。外泌体含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能,参与免疫反应、抗原递呈、肿瘤转移、心脑血管系统、神经系统等生理和病理过程 。
外泌体可运载不同种类的核酸,如 DNA、mRNA 和 miRNA,rRNA,snoRNA 等,其中 miRNA 受到最多的关注,由于它在基因表达调控上有着重要作用。miRNA 是一类 17-24nt 长的小的非编码 RNAs,是一类重要的 sRNA(small RNA,sRNA)。miRNA 通过与 mRNA 的 3’ UTR 或者开放阅读框 ORF 区域结合,能介导基因的转录后沉默,与细胞增殖分化、迁移、疾病发生和疾病进展都有关系。外泌体的脂质双层膜结构,能很好的保护其包被的 miRNA,使其可作为疾病诊断和预后的生物标志物[2],影响肿瘤生长、增殖和转移。
外泌体smallRNA 测序可以得到不同组织、不同发育阶段、不同疾病状态下 sRNA 的表达情况,其中 miRNA、siRNA 以及 piRNA 是研究的热点,也是项目分析的重点。外泌体smallRNA 测序可以找到不同样本间差异表达的miRNA,也可以鉴定新的miRNA。通过生信分析得到其靶位点所在基因的 GO 功能注释以及KEGG pathway 注释,最终可以得到外泌体 small RNA 在生物体中参与的生命活动的一个清晰的生物信息图谱。
数据量:10M clean reads/样
检测范围广:既能鉴定已知小RNA,又能发现新的小RNA。
(13)已知miRNA的碱基编辑分析;
(3)mir2disease注释.
晚期卵巢癌细胞通常会发生大网膜脂肪组织处的转移,但是网膜基质细胞来源的分子对卵巢癌生长的影响还未见太多报道。本文通过二代测序技术发现肿瘤相关的脂肪细胞和成纤维细胞中miR21的表达量明显高于卵巢癌细胞。通过功能研究发现,肿瘤相关的脂肪细胞和成纤维细胞的miR21可以转移到卵巢癌细胞中,从而抑制卵巢癌细胞凋亡并通过结合一个新发现的靶mRNA—APAF1赋予其化疗抗性。这些数据表明,转移性卵巢癌细胞的恶性表型可通过从相邻网膜基质细胞来源的外泌体递送miR21来获得,抑制基质细胞来源的miR21可能是治疗转移性或复发性卵巢癌的一个新策略。
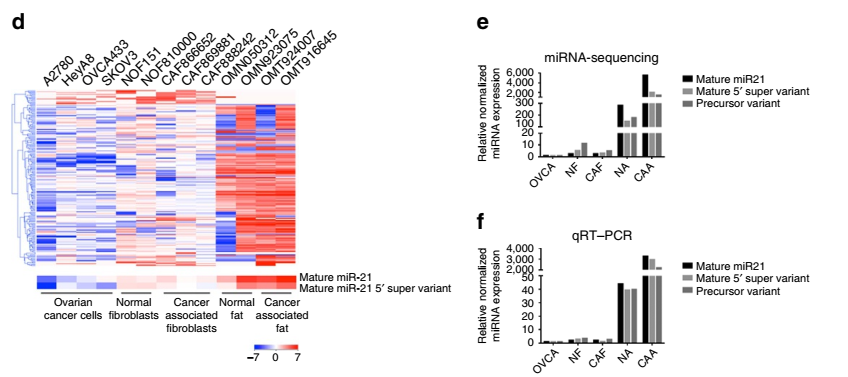
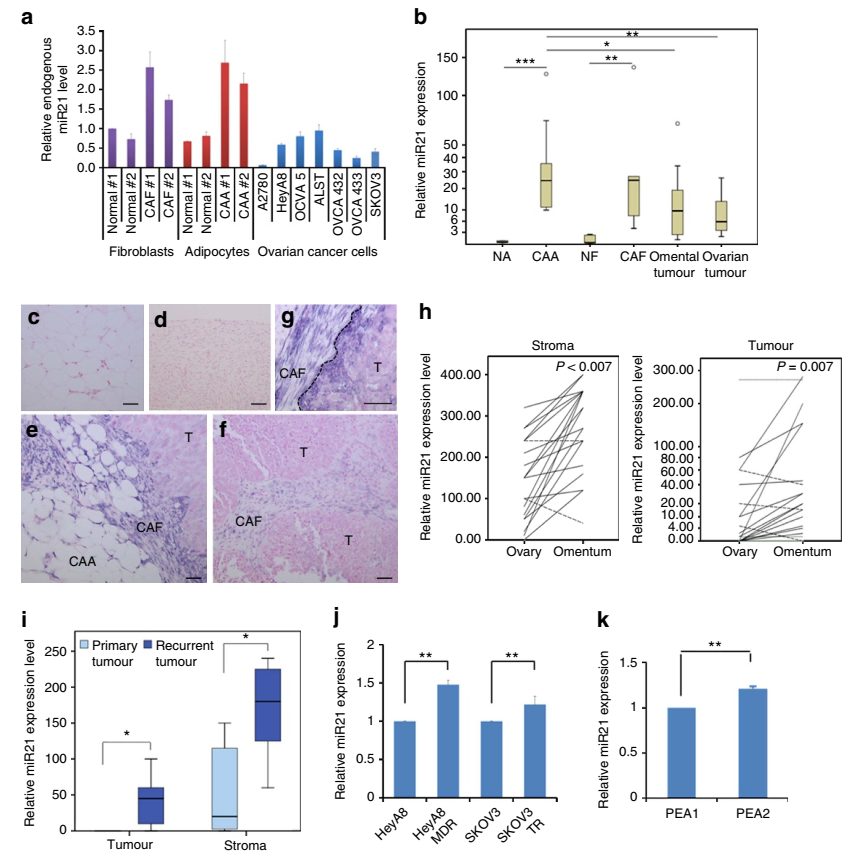
图2 卵巢肿瘤组织和肿瘤细胞系中miR21的表达差异情况
案例(2)外泌体miRNA可用于非小细胞肺癌的早期诊断
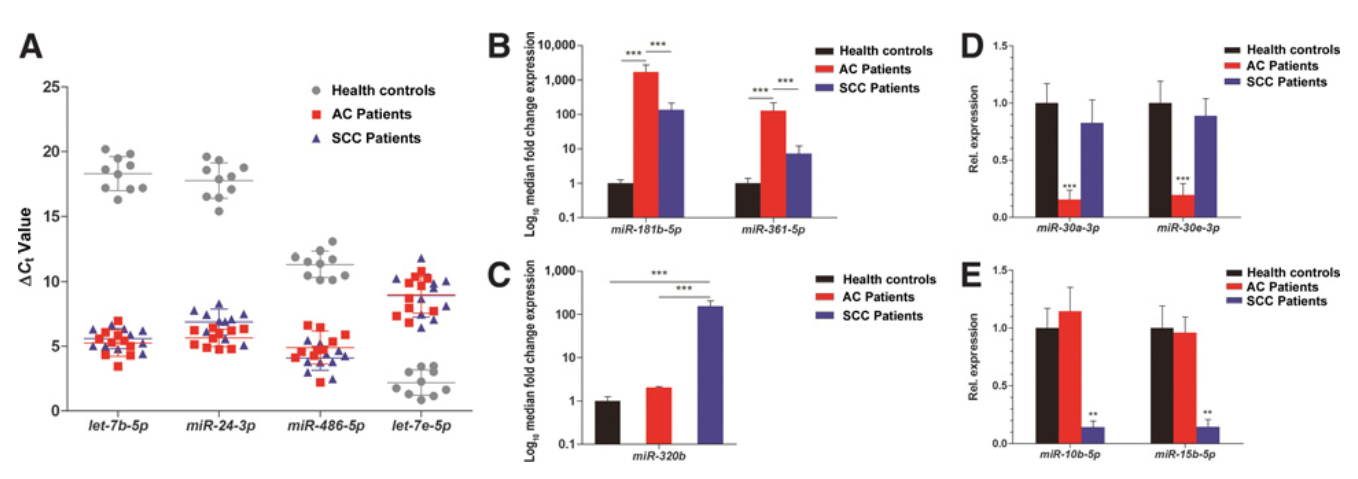
该研究从早期非小细胞肺癌(NSCLC)患者的血浆中分离肿瘤来源的外泌体。利用miRNA-seq对46个I期NSCLC患者和42个健康个体的外泌体miRNA进行分析,以鉴定和验证腺癌(AC)和鳞状细胞癌(SCC)的特异性miRNA。与健康个体相比,AC和SCC患者分别有11个和6个miRNA表达水平显著增高,13个和8个miRNA表达水平显著降低。不同的腺癌和鳞癌特异性的外泌体miRNA进一步被验证。与以前研究报道一致,miRNA-seq数据证实了可用于诊断NSCLC和其他癌症的潜在miRNA,如let-7、miR-21、miR-24和miR-486。结果表明,miR-181-5p、miR-30a-3p、miR-30e-3p和miR-361-5p为AC特异性的,miR-10b-5p、miR-15b-5p和miR-320b为SCC特异性的。采用AUC值为0.899、0.936和0.911,分别检测NSCLC、AC和SCC,评估三种组合miRNA组的诊断准确度。这些miRNA在用于早期NSCLC诊断并用于高度敏感的非侵入性生物标志物是非常有希望的。
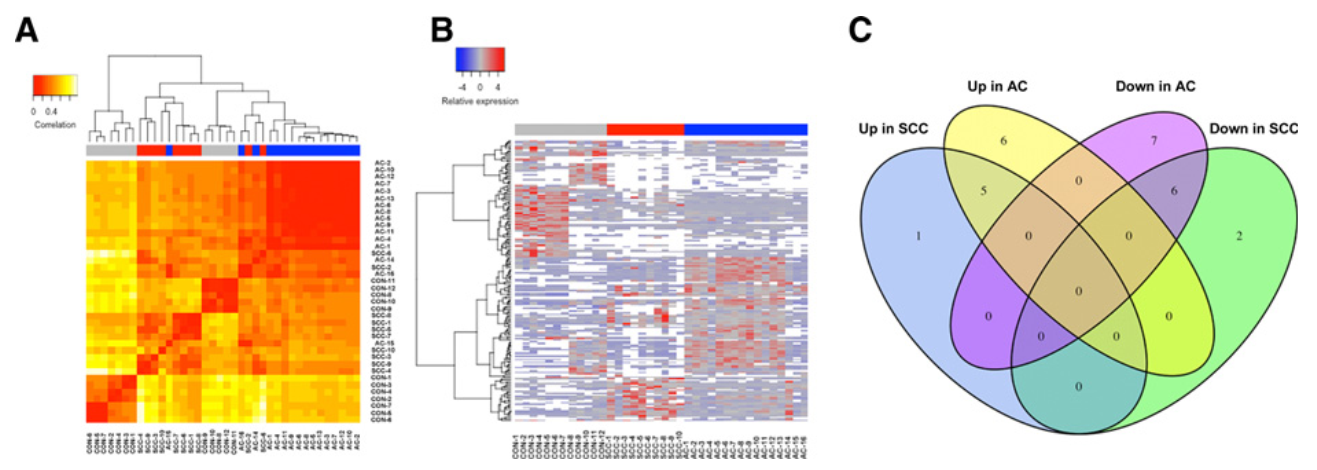
图1 鉴定和定量健康个体、AC患者和SCC患者肿瘤来源的外泌体
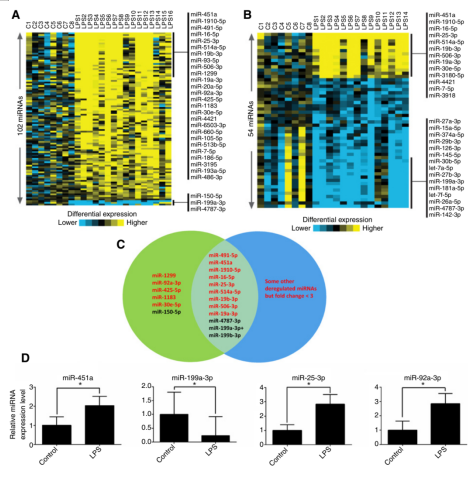
LPS患者样本中PBV和PB的miRNA表达情况
[1] Au Yeung et al. Exosomal transfer of stroma-derived miR21 confers paclitaxel resistance in ovarian cancer cells through targeting APAF1. Nature Communications, 2016.
[2] Jin et al. Evaluation of tumor-derived exosomal miRNA as potential diagnostic biomarkers for early stage non-small-cell lung cancer using next-generation sequencing. Clinical Cancer Research, 2017.
[3] Casadei et al. Exosome-derived miR-25-3p and miR-92a-3p stimulate liposarcoma progression.Cancer Research, 2017.